
鹅骨髓中性粒细胞分离液试剂盒
产品名称: 鹅骨髓中性粒细胞分离液试剂盒
英文名称: Kits of goose bone marrow neutrophil separation solution
产品编号: P2140
产品价格: 0
产品产地: 北京市通州区马驹桥联东U谷386A
品牌商标: solarbio
更新时间: 2024-12-05T09:48:33
使用范围: null
- 联系人 : 索莱宝-龚思雨
- 地址 : 北京市通州区中关村科技园区通州园金桥科技产业基地景盛南四街15号85A三层
- 邮编 : 101102
- 所在区域 : 北京
- 电话 : 178****1073 点击查看
- 传真 : 点击查看
- 邮箱 : 3193328036@qq.com
- 二维码 : 点击查看
鹅骨髓中性粒细胞分离液试剂盒
操作步骤:
1. 制备骨髓的单细胞悬液。
2. 在离心管中加入适量分离液(细胞悬液体积小于5mL时,加入5mL分离液;大于等于5mL,加入等体积分离液。但二者的总体积不能超过离心管的三分之二,否则会影响分离效果),将细胞悬液平铺到分离液液面上方,注意保持两液面界面清晰。(可以使用巴氏德吸管吸取细胞悬液,然后小心的平铺于分离液上,因为两者的密度差异,将形成明显的分层界面。如果样品较多,加样的时间较长,在离心之前出现红细胞成团下沉属正常现象。)
3. 室温,水平转子500~1000g,离心20~30min(细胞悬液的体积越大所需的离心力越大,离心时间越长,最佳的分离条件需摸索,离心转速最大不超过1200g)。
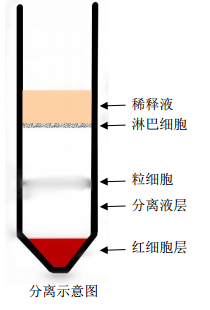
4. 离心后将出现明显的分层:最上层是稀释液;稀释液与分离液之间是淋巴细胞层;分离液中为粒细胞层(个体差异或者是分离条件不同,粒细胞层可能分离不明显);最下层为红细胞层。
5. 小心的吸取分离液层到15mL洁净的离心管中,10mL PBS或细胞洗涤液洗涤白膜层细胞。250g,离心10min(如有红细胞混杂则加入适量红细胞裂解液)
6. 弃上清,5mL的PBS或细胞清洗液重悬细胞,250g,离心10min。
7. 重复步骤6
8. 弃上清,细胞重悬备用。
骨髓单细胞悬液的制备方法
小动物骨髓的采集:
1. 处死动物,无菌提取股骨和胫骨,剪去两端软骨,露出红色的骨髓腔(注意尽可能少的剪走骨髓腔)。
2. 取1ml的无菌注射器,吸取少量的含有10%标准胎牛血清的稀释液或者是含有血清的培养基,冲洗骨髓腔以获得骨髓。
3. 最终制备成2×108–1×109/ml 的单细胞悬液备用。
大动物骨髓的采集:
大动物骨髓的采集可采取活体穿刺方法:先将动物麻醉、固定、局部除毛、消毒皮肤,然后估计好皮肤到骨
分离示意图
髓的距离,把骨髓穿刺针的长度固定好。操作人员用左手把穿刺点周围的皮肤绷紧,右手将穿刺针在穿刺点垂直刺入,轻轻左右旋转将穿刺针钻入,当穿刺针进入骨髓腔时常有落空感。连接注射器缓慢抽吸骨髓组织,当注射器内抽到少许骨髓时即停止抽吸。用含10%标准胎牛血清的稀释液调整细胞浓度为2×108–1×109/ml 的单细胞悬液备用。
常用的骨髓穿刺点:
股骨:穿刺部位在股骨内侧面,靠下端的凹面处;
胸骨:穿刺部位是胸骨体与胸骨柄连接处;
肋骨:穿刺部位是第5~7肋骨各点的中点;
胫骨:穿刺部位是股骨内侧、靠下端的凹面处。如果穿刺采用的是肋骨,穿刺结束后要用胶布封贴穿刺孔,防止发生气胸。
注意事项:
A. 开封前颠倒混匀,本分离液为无菌产品,为延长分离液保存时间,请在无菌条件下启封,避免微生物污染。。
B. 分离液使用时应始终保持室温(18℃~25℃),如室内温度较低,可将分离液预热。4℃或者是温度较低的条件下离心,可能会导致白膜层中红细胞污染加重。
C. 洗涤细胞,不可使用含Ca、Mg离子的缓冲液及培养液,其成分会导致血细胞凝集,大大降低细胞得率及纯度。
D. 部分塑料制品(如聚苯乙烯)因其带有的静电作用,可能会导致细胞挂壁,影响分离效果。
E. 如果要进一步对分离的细胞进行培养,那在收集血液和分离过程中,注意无菌操作,避免微生物污染。
F. 不同动物血液在不同比重分离液中的细胞离散系数及细胞带电不同,用户在制定分离液时应提供所需分离液的比重、动物种属及被分离细胞的名称。
参考文献
1. Boyum A. Separation of leucocytes from blood and bone marrow. Scand J Clin Lab Invest Suppl. 1968; 97: 7.
2. Ting A, Morris PJ. A technique for lymphocyte preparation from stored heparinized blood. Vox Sang. 1971 Jun;20(6): 561-3.
3. Boyum A. Separation of Blood Leucocytes, Granulocytes and Lymphocytes Tissue Antigens. 1974; 4(4): 269-74.
4. Weisbart RH, Webb WF, Bluestone R, Goldberg LS. A simplified method for lymphocyte separation. VoxSang. 1972; 23(5): 478-80.
5. Recalde HR. A simple method of obtaining monocytes in suspension. J Immunol Methods. 1984 Apr 13;69(1):71-7.
6. BøyumA,LøvhaugD,TreslandL.Separation of leucocytes: improved cell purity by fine adjustments of gradient medium density and osmolality. Scand J Immunol. 1991 Dec; 34(6):697-712.
7. Harris R, Ukaejiofo EO. Tissue typing using a routine one-step lymphocyte separation procedure. Br JHaematol. 1970 Feb; 18(2):229-35.
相关产品:
R1018 细胞洗涤液
S9020 优级胎牛血清
R1017 全血及组织稀释液
31800 RPMI Medium 1640
T1300 胰蛋白酶-EDTA消化液(0.25%)不含酚红
YA0902 一次性巴氏德吸管
各种其他动物及其他细胞的分离液及试剂盒
